Ein Beitrag unseres regelmässigen -> Kolumnisten <- "Toni", der im "BioTonicum" das Geschehen in der Biotech-Branche begleitet.
Vor wenigen Tagen erschien im Fachjournal Nature Biotechnology ein Artikel zur Preisgestaltung der Gentherapie (The special case of gene therapy pricing, Nature Biotechnology, 2014; 32 (9): 874)
Die Autoren schlagen hier ein alternatives Modell zur Bezahlung gentherapeutischer Behandlungen vor. Da diese sehr teuren Therapien in der Regel nur einmalig ausgeführt werden müssen, sieht ihr Modell eine Art jährliche Ratenzahlung vor, deren Höhe vom Erfolg der Therapie abhängig sein soll. Diese Modell soll den pharmazeutischen Firmen finanzielle Mittel für ihre aufwendige Forschung sichern und gleichzeitig die Kassen des Gesundheitssystems schonen.
Nun ist es allerdings gar nicht meine Absicht, dieses oder ähnliche Modelle zu diskutieren. Vielmehr nehme ich den Artikel zum Anlaß, über den Stand der Gentherapie zu schreiben.
Ist die Gentherapie schon soweit fortgeschritten, dass diese Fragen jetzt in den Vordergrund rücken? Um ein besseres Verständnis für die Entwicklungen in der Gentherapie zu bekommen, will ich heute versuchen, einige Aspekte zu beleuchten.
Was versteht man unter Gentherapie
Wenn auch die molekularbiologischen und medizinischen Zusammenhänge alles andere als trivial sind, so kann man es etwas trocken so formulieren:
Eine medizinische Maßnahme, bei der ein mutiertes Gen, dessen Defekt ursächlich für die betreffende Erkrankung ist, durch das „gesunde“ Gen ersetzt wird. Dabei muss das Gen (bzw die DNA) in die Zellkerne (Nukleus) der Organe oder des Gewebes hineingeschleust werden, in denen es dann als korrekte Vorlage für die Proteinsynthese dient (DNA--> messengerRNA--> Protein). Außerdem soll die DNA stabil in die chromosomale DNA integriert werden. Das neue Gen sollte aber nicht an Stellen im Genom integriert werden, an denen es möglicherweise mehr Schaden als Nutzen anrichtet; nämlich dann, wenn durch sein Einfügen in den DNA-Strang die ursprüngliche Sequenz zerstört bzw. unterbrochen wird (Insertionsmutagenese). Außerdem müssen auch die genetischen Elemente, die für die Regulation des Gens sorgen, vorhanden sein und hoffentlich funktionieren.
Etwas zur Geschichte
Erkrankungen, deren genetische Ursachen schon seit Jahrzehnten bekannt und die mittels konventioneller Medikamentation nicht zu heilen sind, sind z.B. die Mukoviszidose (zystische Fibrose) oder bestimmte Formen der Bluterkrankheit (Hämophilie).
Die Idee, Krankheiten durch den Austausch oder das Einbringen eines Gens zu heilen ist im Grunde so alt wie die Entdeckung der Nukleinsäuren als Träger unserer Erbinformation. Oswald T. Avery postulierte das 1944 aufgrund seiner bahnbrechenden Arbeiten.
Konkreter wurden diese Ideen aber erst in den 1970er Jahren als die Molekularbiologie schon weit fortgeschritten war. Der genetische Code wurde bereits durch Severo Ochoa entziffert und Jaques Monod präsentierte- ebenfalls ein Geniestreich- das Operon-Modell zur Genregulierung. 1972 wurde erstmals fremde DNA in Bakterien (E.Coli) exprimiert.
Mit der Kettenabruchsequenzierung durch Frederick Sanger und Walter Gilbert Mitte der 70er nahm die Molekularbiologie dann aber richtig Fahrt auf.
Trotz all dieser unglaublichen Fortschritte galt die Gentherapie noch als unreife Idee, zu deren Verwirklichung wesentliche Punkte an Grundlagenwissen fehlten.
In den frühen 70er Jahren wurden erste Versuche mit Zellkulturen oder in Tiermodellen erforscht und in den 80er Jahren fügte man rekombinante DNA, also DNA die mittels der molekularbiologischen Techniken erzeugt wird, in Viren ein, um sie mit deren Hilfe in die Körperzellen einzuschleusen. Dabei wurden körpereigene Zellen des Patienten entnommen, die dann ex vivo mit der DNA bzw. dem viralen Vehikel behandelt wurden bevor sie wieder transplantiert wurden. Später wurde dann versucht, die DNA mit verbesserten Vektoren bzw. Vehikeln direkt in den Körper des Patienten zu transportieren (in vivo).
1990 wurde die weltweit erste Gentherapie in den USA durchgeführt:
Bei der Patientin handelte es sich um ein 4 jähriges Mädchen, das an dem schweren kombinierten Immundefekt (-> SCID <-) litt. Bei dieser sehr seltenen Krankheit bildet das Knochenmark keine funktionstüchtigen B- und T-Zellen. Einzige Therapiemöglichkeit bis dahin war die nicht ungefährliche und komplikationsreiche Stammzelltransplantion des Knochenmarks. Der Erfolg dieser Maßnahmen hing daher auch von der Existenz eines geeigneten Spenders ab.
Dieser Therapie, die wegen der kurzen Lebensdauer der genetisch veränderten Leukozyten mehrmals im Jahr wiederholt werden musste, ging ein dreijähriges Genehmigungsverfahren voraus. Im Laufe der nächsten Jahre wurden mehrere Patienten mit ähnlichen Krankheiten auch in Europa behandelt. Obwohl die Therapie erfolgreich ansprach, erkrankten aber einige Patienten nach Jahren an Leukämie. Es wird angenommen, dass dies durch die oben erwähnte Insertionsmutagenese verursacht wird.
1999; Der Rückschlag:
Der damals 18 jährige Jesse Gelsinger, der an der Ornithin-Transcarbamylase-Defizienz litt, überlebte die Therapie aufgrund einer Überreaktion seines Immunsystems auf die Adenoviren, die als Genvektor dienten, nicht.
Im Gegensatz zur konventionellen Therapie , bei der ein Medikament abgesetzt werden kann, sobald sich Unheil ankündigt, ist dies bei der Gentherapie nicht möglich. Ist ein Gen erst einmal im Genom integriert, so gibt es kein zurück mehr.
Für die Gentherapie versprach das nichts Gutes; die FDA stoppte klinische Studien, auch um die ethischen und medizinisch-biotechnologischen Fragen neu zu überdenken. Versuche, die Gentherapie zu kommerzialisieren gerieten in weite Ferne und den wenigen Biotechfirmen, die hierauf spezialisiert waren, drohte ein abruptes Ende.
Zu den wissenschaftlichen Rückschlägen gesellte sich auch die Ablehnung dieser Technik in der Bevölkerung; sei es nun aus ethischen oder religiösen Gründen oder aber aus der Angst vor einer Medizin, deren Risiken überhaupt noch nicht abzuschätzen sind.
Dazu kam noch, dass die Vorstellung über das, was Gentherapie bedeutet, doch sehr vage war (ist).
Natürlich wird heute auch in den Medien vermehrt über die Möglichkeiten der Gentherapie berichtet. Gerade dann, wenn es darum geht, in naher Zukunft Menschen mit Mukoviszidose zu heilen und nicht nur die Symptome zu bekämpfen. Aber häufig verbindet man mit Gentherapie reproduktives Klonen oder Wissenschafltler der Embryonalstammzellforschung, die es mit der eigenen Reproduktion (ihrer Daten) nicht so genau nehmen.
Die Forschung zur Gentherapie führte in den letzten Jahren dennoch zu einem enormen Erkenntnisgewinn. „Versuche“ an seltenen genetischen Erkrankungen offenbarten dabei erstaunliche Erfolge. Dabei steht die Entwicklung sicherer und effizienterer Vektoren, die das Gen zielsicher an den Ort des Geschehens bringen sollen, im Vordergrund.
Biotechs und Pharmaindustrie:
Trotz der -> Fehlschläge <-, mit denen die Gentherapie immer noch zu kämpfen hat, wächst die Zahl der Biotechfirmen und Startups, die sich darauf spezialisiert haben, diese Technik zu kommerzialisieren. Fast alle Pharmaunternehmen betreiben dazu Forschungen oder kooperieren mit Biotechs.
2012 ließ die EMA (European Medicines Agency) unter sehr strengen Auflagen und zeitlicher Begrenzung das erste gentherapeutische "Medikament" zu (zumindest in der westlichen Welt):
Glybera; entwickelt von der niederländischen Firma UniQure (NASDAQ: QURE) zur Behandlung der sehr seltenen Lipoprotein Lipase Defizienz. Die Therapie erscheint dabei fast simpel aber mit 1,6 Millionen Euro auch nicht gerade billig:
Mehrere intramuskuläre Injektionen eines Adeno-assoziierten viralen (AAV) Vektors, der das korrekte Gen für die benötigte Lipase in sich trägt. Um die nicht ungefährliche Immunantwort auf virale Proteine zu unterdrücken, werden die Patienten allerdings mit Immunsuppresiva behandelt. Ein stationäre Behandlung, bei der Gewebe oder Zellentnahme oder aber eine Chemotherapie angewendet wird, ist nich nötig; lediglich die Unterweisung des Arztes ist nötig. So einfach ist es leider nicht bei allen Gentherapien.
Bluebird Bio
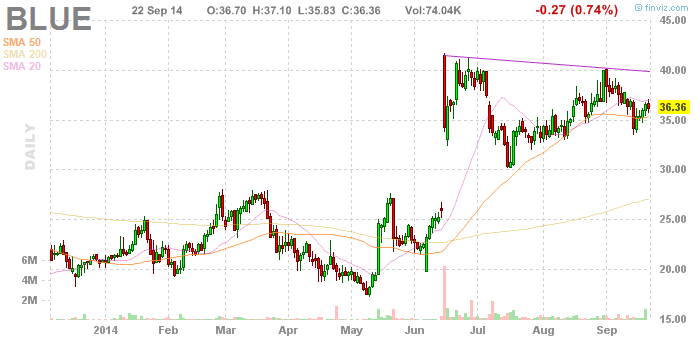
Dieses Jahr (2014) wurde erstmals ein Patient mit ß-Thalassämie durch das von BlueBird Bio entwickelte gentherapeutische Verfahren erfolgreich behandelt.
Bei dieser Krankheit, genauer bei der schwerwiegensten Form- der Thalassämia major, führen Mutationen im ß-Globin-Gen zu einem nicht voll funktionstüchtigen Hämoglobin und damit zur Bildung defekter roter Blutkörperchen. Bislang bestand die kurative Therapie in der Transplantation hämatopoietischer Stammzellen eines geeigneten, meist verwandten Spenders. Zuvor müssen alle Zellen des Knochenmarks durch Chemotherapie und Bestrahlung zerstört werden. Ein Video dazu findet man auf Bluebirds Website.
2012 wurde Bluebird Bio von FierceBiotech zu den 15 zukunftträchtigsten Biotechs gewählt. “The Fierce 15 celebrates the spirit of being ‘fierce’ – championing innovation and creativity, even in the face of intense competition.”
Bluebirds Börsengang im letzten Jahr brachte dem Unternehmen 116 Millionen Dollar ein. Eine Summe die wohl die Bedeutung, die Investoren der Gentherapie zumessen, unterstreicht. Bluebirds Programme beschränken sich dabei nicht nur auf die Thalassämien.
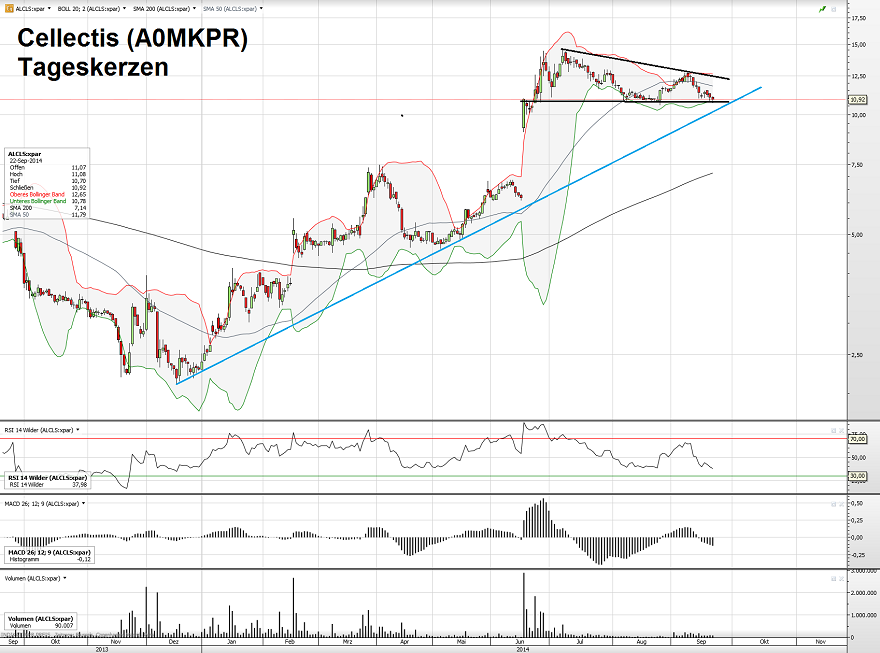
Hier einmal der aktuelle Chart (Mitte Juni: Bericht über die offenbar erfolgreiche Therapie)
Bluebird, aber natürlich auch ander Wissenschaftler aus Forschung und Industrie versuchen, die Technik des gezielten Gentransfers weiterzuentwickeln. Ideal wäre es ja, wenn man nur den defekten DNA-Bereich gegen die korrigierte DNA-Sequenz (bei einer Punktmutation nur eine Base) austauschen könnte. Damit bliebe das Gen in seiner ursprünglichen chromosomalen Umgebung erhalten. Insertionsmutationen sollten so ausgeschlossen sein und auch die Regulation des Gens sollt genauso funktionieren wie im gesunden Menschen.
Die molekularbiologischen Methoden, Gene wie mit dem Skalpell punktgenau zu modifizieren oder gezielt an einen Ort zu übertragen („Gen Editing“) haben in den letzten Jahren unglaubliche Fortschritte erzielt. Über die Entdeckung des CRISPR-Systems habe ich hier im Forum schon berichtet.
Es ist natürlich nicht verwunderlich, dass Gentechnikfirmen ein vitales Interesse am Erwerb entsprechender Lizenzen zum Genediting erhalten. Bluebird Bio übernahm dieses Jahr die Firma “Precision Genome Engineering” um deren Homing Endonukleasen zu nutzen.
Gentherapie in der Krebstherapie?
Die hier erwähnten Behandlungen monogener Erkrankungen (Krankheiten, die nur auf den Defekt eines Gens zurückzuführen sind) gelten als Paradebeispiel für die Gentherapie im Sinne einer Heilung durch genetische Korrektur. Es scheint, als sei diese Form der Therapie längst aus den Kinderschuhen heraus gewachsen.
Schaut man sich die Pipelines von Firmen wie Bluebird, Kite Pharma, Cellectis oder Juno Therapeutics an, so wird man dort auch Programme zur Behandlung verschiedener Krebserkrankungen finden. Der gentherapeutische Ansatz bei Erkrankungen, die von mehreren Genen verursacht werden, ist hier allerdings ein anderer.
Dies führt uns zu einem der interessantesten Ansätze im Grenzbereich Gentherapie: der adoptiven T-Zelltherapie mittels der CART-Technologie.
Das Prinzip ist, Lymphozyten eines an Krebs Erkrankten zu isolieren und nach entsprechender Aktivierung wieder in den Körper zurückzugeben sehr alt.
Schon 1891 wurde eine Methode der Aktivierung von Lymphozyten in Tumoren angewandt. Trotz einiger aufsehenerregender Berichte blieben reproduzierbare und wissenschaftlich fundierte Erfolge aber aus.
Zu den neueren Erfolgen eines adoptiven T-Zell-Transfers zählen u.a. die Behandlung von Hodgkins Lymphomen (Lymphogranulomatose) durch Epstein-Barr-Virus Infektionen, die sehr häufig nach Stammzelltransplantationen auftreten. Leider funktioniert dieser Ansatz aber nur wenn bestimmte Ausgangsbedingungen vorhanden sind. Das ist nicht immer Fall.
Verschiedene Programme konzentrieren sich darauf, diese körpereigenen Lymphozyten, die sich im Tumorgewebe befinden (Tumor infiltrating Lymphocytes, TIL), außerhalb des Körpers mit Methoden zu aktivieren, die wir neuen Erkenntnissen über Immunregulation und Tumorevasion verdanken.
Mit der von Carl June (Juno Therapeutics) entwickelten CART-Technologie werden nun diese körpereigenen (autologen) T-Zellen des Erkrankten genetisch verändert, um sie angriffslustiger zu machen. CART steht für „Chimeric Antigen Receptor T-Cell".
Im Prinzip handelt es sich hierbei um einen artifiziellen T-Zell-Rezeptor, der genetisch so verändert wird, dass er bestimmte Antigene, die auf den Tumorzellen des Patienten exprimiert werden, besser erkennt. Außerdem besitzt dieser Rezeptor eine zusätzliche Domäne, die der Stimulation der T-Zelle dient. Diese ist Voraussetzung für eine effiziente zytotoxische Antwort.
Die CART-Therapie gilt neben den uns schon bekannten Immuncheckpoint Antikörper-Therapien (-> Breakthrough of the Year 2013 <-), zu der wir ja schon hier bei Mr-Market einige Firmen kennengelernt haben, als eines der vielversprechendsten und heißesten Unterfangen im Bereich der Onokologie.
Sicherlich ein Begriff, der etwas überstrapaziert wird, aber die bisherigen Studien zu Leukämieerkrankungen mögen dieses Attribut rechtfertigen.
Der „Markt“ um die CART- Technologie ist ziemlich unübersichtlich, nicht zuletzt weil die Forschungen aus der Zusammenarbeit verschiedener akademischer, nationaler und privater Institute (Fred Hutchinson Cancer Research Center, Memorial Sloan Kettering, National Cancer Institute etc) hervorgingen und weil man sich auf unterschiedliche CART-Varianten und Technologien konzentriert .
Allein in den letzten 2 Jahren haben "CART-Firmen" zwei- bis dreistellige Millionen Beträge über IPOs oder privat aufnehmen können:
Kite Pharma (IPO 2014, $115M) aus Santa Monica benutzt CARTs lizensiert vom National Cancer Institut.
Juno Therapeutics, der Vorreiter hat schon in weniger als einem Jahr 300 Millionen US-Dollar eintreiben können. Novartis unternimmt zusammen mit Forschern der Universität von Pennsylvania (UPenn) und Juno Therapeutics alle Anstrengungen, die CART-Technologie für die akute lymphoblastischen Leukämie zur „Marktreife“ zu bringen. (Mittlerweile scheinen sich Junos und Novartis Wege aber in einigen Bereichen zu trennen, da die Firmen angeblich mit unterschiedlichen CARTs aufgrund von Patentstreitigkeiten arbeiten wollen.)
Auch im CART-Geschäft ist nun der Gentechnik-Experte Bluebird Bio in Zusammenarbeit mit Celgene .
Pfizer versucht offensichtlich einmal mehr seine schwache Position im Onkologiemarkt aufzupeppen. Der Riese ist bereit, der französischen Firma Cellectis 185 Millionen Dollar an Meilensteinzahlungen für jedes erfolgreiches CART-Projekt zu überweisen (es sind immerhin 15).
Cellectis dürfte den Kontrahenten vom wissenschaftlichen know-how zwar weit hinterherhinken; dafür fahren sie aber eine andere, möglicherweise viel attraktivere Strategie:
Cellectis modifiziert nicht in mühseliger Weise die T-Zellen des Patienten, sondern sucht in Spendern nach geeigneteren Lymphozyten, die schon diverse "Krebsantigen" erkennen. Auf diese Art entwickeln sie eine Kollektion verschiedener CARTs, die dann Patienten sofort zur Verfügung ständen.
Dass die im Juni vorgestellten Daten überaus positiv bewertet werden, kann man schön am Kursverlauf der Cellectis-Aktie bewundern.
Fazit
Bei allem Enthusiasmus darf man nicht vergessen, dass sich die Gentherapie noch in einem frühen Stadium befindet.
Vergleichen wir das mit dem langen Weg der monoklonalen Antikörper von ihrer Herstellung durch Köhler und Milstein 1975 bis zu ihrem heutigen Durchbruch in der Medizin, so darf man aber erstaunt sein, wie weit die therapeutischen Ansätze schon gediehen sind.
Wann die Türen zu einer routinemäßigen Klinik geöffnet werden, ist schwer zu beantworten. Genauso offen bleibt die Frage, ob diese meist individuellen ("personalisierten") kurativen Therapien in der Zukunft überhaupt wie konventionelle Medizin vermarktet werden können.
Für die Gesundheitssysteme und die nationalen Zulassungsbehörden von Arzneimittlen ergeben sich auf jeden Fall neue Fragestellungen und große Herausforderungen.
Und auf der Seite der Pharmaindustrie werden sich wahrscheinlich schon Heerscharen von Patentanwälten und Juristen mit dem geistigen Eigentum zur genetischen Modifizierung einer autologen Körperzelle beschäftigen. Aber das soll jetzt nicht das Thema sein.
In einem späterern Artikel im Mitglieder-Bereich, werde ich einige Biotechs und Methoden zur Gentherapie vorstellen, die einen völlig anderen Weg gehen. Noch befinden sich diese Versuche in der experimentellen Phase. Die Technologie, die hier genutzt wird, könnte große Vorteile bieten.
Toni
Diskutiere diesen Beitrag im Forum
*** Bitte beachten Sie bei der Nutzung der Inhalte dieses Beitrages die -> Rechtlichen Hinweise <- ! ***